Per secoli l'uomo ebbe a disposizione come
fonte di energia meccanica (cioè in pratica per muovere
qualcosa) i soli muscoli, suoi o di qualche animale.
Se si voleva sollevare acqua da un pozzo occorreva che
qualcuno come minimo facesse girare una ruota a forza di
braccia.
Poi si riuscì a sfruttare in qualche modo i fluidi in
movimento (mulini a vento o mulini ad acqua). |
 |
 |
 |
 |
 |
| Fu un buon passo avanti ma il
limite era dovuto alla disponibilità del fluido in movimento
... (posso anche pensare di saper costruire un mulino ad
acqua, ma in un deserto non mi serve a nulla).La vera
"rivoluzione" che cambiò la vita dell'uomo fu il riuscire a
trasformare l'energia termica, il "calore" del fuoco, in
energia meccanica. Il "come" venne in mente ad un certo
Denis Papin, intorno alla fine del '600 ... Papin
inventò la "pentola a pressione" (lui la chiamò "digesteur"
.. "digestore", perché permetteva di far bollire il cibo a
temperature più alte dei 100°C che si possono ottenere in
acqua a pressione ambiente e quindi rendere commestibili
anche cibi che con le pentole normali non si riuscivano a
cuocere) e dall'osservazione che il vapore prodotto in
questa pentola aumentava di pressione venne (sempre a Papin)
l'idea di sfruttare la cosa per far muovere un pistone,
inventando di fatto una prima "macchina a vapore" (la
macchina di Papin era un cilindro con un pistone - si
metteva acqua nel cilindro e si scaldava sino ad ebollizione
- la pressione prodotta dal vapore faceva salire il pistone.
Si lasciava poi raffreddare il cilindro e quindi il pistone
scendeva ... il sistema era decisamente poco pratico,
la macchina di Papin riusciva a fare solo UN ciclo al
minuto, ma fu il primo esempio di movimento meccanico
ottenuto in qualche modo grazie all'energia termica). |
|
|
Il ciclo
termodinamico e la macchina di Carnot |
Il CICLO TERMODINAMICO è un
insieme di trasformazioni termodinamiche (riscaldamento,
espansione, compressione, raffreddamento ...) una di seguito
all'altra che fanno variare lo stato di un sistema in modo
vario sino a riportarlo allo stato iniziale.
Il ciclo termodinamico si rappresenta su un piano cartesiano
che ha per ascisse (le X) il VOLUME e per ordinate (le Y) la
PRESSIONE. Questo sistema di coordinate si chiama PIANO DI
CLAPEYRON.
Ad esempio, per la macchina a vapore che abbiamo visto
prima, il ciclo termodinamico si rappresenterebbe come nella
figura a lato.
Cominciando dal punto 1 troviamo il tratto 1-2, nel
diagramma è una linea parallela all'asse V (cioè non varia
la pressione - sappiamo già che pressione costante si dice
ISOBARA).
Nella macchina a vapore corrisponde alla fase in cui viene
surriscaldato il liquido che da liquido diventa vapore - non
varia la pressione ma cambia il volume.
Nella fase 2-3 il vapore si espande o spingendo il
pistone o facendo girare una turbina.
Secondo la nostra legge PV=nRT
in questa fase perdiamo P e guadagniamo V, senza scambiare
calore con l'esterno (quando non scambiamo calore con
l'esterno diciamo che la trasformazione è ADIABATICA -
questo può accadere o perché il nostro sistema è isolato o
perché la trasformazione avviene in tempi molto rapidi e non
c'è il tempo per disperdere calore).
Nella fase 3-4 (nel digramma è di nuovo parallela
all'asse V e quindi è ancora ISOBARA) il vapore si raffredda
all'interno di un condensatore (qui cede calore
all'ambiente) e torna liquido.
Nella fase 4-1 che chiude il ciclo il nostro liquido
viene pompato dentro la caldaia ad alta pressione ma non
aumenta di volume (è liquido, che è una fase caratterizzata
da volume costante - e infatti la linea è parallela all'asse
P) |
 |
Se in un cilindro un gas si espande e sposta un pistone,
il lavoro che questo gas compie è, per come avevamo definito
il lavoro Fxh (cioè forza per spostamento del pistone).
Ora dobbiamo fermarci un attimo e fare un piccolo
ragionamento ... io lo definisco "dimensionale".
Il volume del cilindro è S (superficie della base) x h
(altezza) - la forza che agisce sul pistone è ancora F = P x
S (Forza = Pressione x Superficie della base, che è anche
quella del pistone).
Quindi supponendo per prima approssimazione che la pressione
non vari durante un piccolo spostamento avremmo che il
lavoro è L=PxSxh ma siccome Sxh è il volume V abbiamo che L
= PxV.
Questo non è vero però, perché mentre il volume aumenta la
pressione diminuisce, ma è vero per un piccolissimo
spostamento del pistone. |
 |
Ragionando sul nostro diagramma (ecco a cosa serve !!!) vediamo
che PxΔV
è il prodotto delle due variabili, cioè (se facciamo ad esempio
aumentare il volume a P costante, che è quello che abbiamo
ipotizzato un attimo fa) è l'area del rettangolo che ha per lati
ΔV e P
(variazione di volume x pressione).
Vediamo quindi i possibili casi:

- Nella fase 1-2 cioè quella di espansione dovuta al
riscaldamento il lavoro è semplicemente il prodotto
della variazione di volume per la pressione (costante) -
l'area è un rettangolo
- Nella fase 2-3 il lavoro è dato dal movimento del
pistone - il volume aumenta ma diminuisce la pressione -
nella figura la cosa è rappresentata come se fosse
"lineare" e in quel caso l'area sarebbe quella di un
trapezio.
- Nella fase 3-4 è il mio sistema che cede calore
all'esterno e quindi "perde" lavoro restituendo calore -
anche qui l'area è un rettangolo
- Nella fase 4-1 non c'è variazione di volume e
quindi, per come lo abbiamo definito, il lavoro sarà
zero.
Se facciamo le somme delle aree con lavoro positivo
(rosse) meno quelle con il lavoro negativo (blu) otteniamo
di fatto che il lavoro compiuto durante un ciclo
termodinamico è uguale all'area racchiusa dalla linea che lo
rappresenta.
Il bello è che questo risultato vale anche quando la forma
del mio diagramma è più complicata, e questo diventa un
ottimo motivo per imparare ad utilizzare questi diagrammi. |
 |
 |
Un particolare ciclo termodinamico è il CICLO DI CARNOT.
Questo è un ciclo TEORICO riferito ad un gas che viene
compresso e poi espanso in un cilindro, scambiando calore
con l'esterno solo tramite il fondo del cilindro mentre il
resto della macchina è perfettamente isolata.
Questo ciclo si dimostra esser quello con il maggior
rendimento possibile e quindi viene preso a riferimento per
il rendimento delle macchine termodinamiche reali.
Il rendimento di una macchina termodinamica è il rapporto
tra il lavoro utile che la macchina compie e il calore che
assorbe.
Nel caso del ciclo di Carnot abbiamo (non impariamole a
memoria, ma impariamo a "leggere" le figure - ricordiamoci
semplicemente che stiamo mettendo a confronto SOLO
variazioni di pressione e di volume, mentre dovremo,
osservando "come" avviene il ciclo, capire quando la
macchina assorbe o cede calore) ancora 4 fasi.
- Nella prima fase si applica sul fondo del cilindro
un riscaldatore a temperatura T1 (alta temperatura) - il
gas si espande a temperatura costante (il mio
riscaldatore serve appunto mantenere costante la
temperatura durante l'espansione) ISOTERMA
- Nella seconda fase si è tolto il riscaldatore e si è
sostituito con un isolante - il gas continua ad
espandersi ma (ricordate PV= nRT?) diminuisce la
pressione e quindi anche la temperatura. ADIABATICA
- Nella fase 3 si toglie l'isolante e si mette una
fonte di calore (in realtà qui è una fonte "fredda", che
assorbe calore) a temperatura T2 (bassa). Il gas si
comprime ma la temperatura resta T2 perché il mio
scambiatore termico assorbe tutto il calore in eccesso.
ISOTERMA
- Nella fase 4 il gas viene ulteriormente compresso,
ma questa volta abbiamo isolato il tutto e la
temperatura sale sino a T1 (quella alta di prima)
ADIABATICA
|
|
Il lavoro compiuto dalla macchina sarà uguale, come
abbiamo visto nelle lezioni precedenti, è ENERGIA, ed è
uguale al CALORE assorbito dal sistema.
In questo caso sarà uguale al calore assorbito meno quello
ceduto.
Siccome la massa (nR) del gas resta costante e durante le
fasi 2-3 e 4-1 non ho dispersione di calore, perché il mio
sistema si suppone perfettamente isolato, il calore si
scambia solo nelle fasi 1-2 e 3-4.
Quindi il lavoro compiuto dalla macchina è L = Q1-Q2 e il
suo rendimento
η
sarà L/Q1 cioè (Q1-Q2)/Q1.
E siccome la massa si mantiene, il calore assorbito o ceduto
è proporzionale alla differenza di temperatura.
Se ne ricava la "regola" fondamentale che da il rendimento
massimo raggiungibile in una macchina termica che sarà  |
 |
|
Con T1 e T2 in Kelvin.
Si vede subito che per avere un rendimento uguale ad UNO
occorrerebbe che T2 fosse zero, cioè lo zero assoluto, e questo
sappiamo che è impossibile.
Ma ne ricaviamo un concetto fondamentale ed è che le macchine
termodinamiche, per migliorare il loro rendimento, devono lavorare a
temperature T1 le più alte possibili, e, in subordine, lavorano
meglio se è bassa la temperatura di riferimento (in genere quella
ambiente) T2. |
|
Il ciclo Otto |
 |
Ora andiamo a vedere come funzionano e come si
interpretano i cicli termodinamici delle macchine più
comuni.
Abbiamo già visto prima il ciclo
Rankine della macchina a vapore, ora vediamo il ciclo
"Otto" (il nome deriva dall'ing. tedesco
Nikolaus August Otto che nel 1862 costruì il primo
motore a scoppio 4 tempi effettivamente funzionante) che
invece descrive il funzionamento dei motori a scoppio.
Nei motori a scoppio 4 tempi riconosciamo 4 fasi (da cui
appunto il nome) molto simili a quelle già viste sino ad
ora:
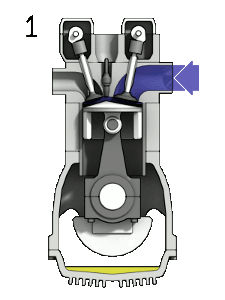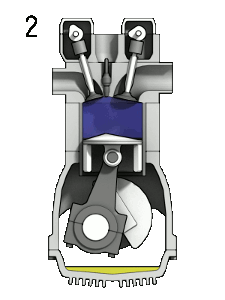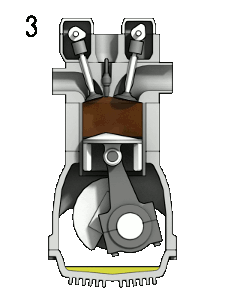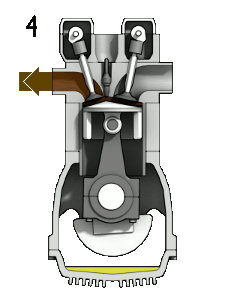
- Aspirazione - si aspira dall'esterno aria e benzina
vaporizzata sino a riempire il cilindro (dal punto di
vista termodinamico questa fase è comune allo scarico -
in realtà noi buttiamo via il gas caldo e ne prendiamo
una quantità uguale fresca)
- Compressione - Il pistone sale e comprime la miscela
di aria e benzina nella camera di combustione
- Combustione ed espansione - (in realtà dal punto di
vista termodinamico sono due fasi) La miscela aria
benzina viene fatta "accendere" da una scintilla.
aumenta la temperatura del gas che si espande, spingendo
il pistone (è l'unica fase di lavoro utile)
- Scarico - il gas pistone sale di nuovo scaricando il
gas combusto (come abbiamo detto, questa fase è
termodinamicamente in comune con la fase di aspirazione.
Termodinamicamente lo vediamo come un raffreddamento del
gas, il fatto che in realtà lo buttiamo via e ne
prendiamo del nuovo è ininfluente)
|
 |
 |
 |
|
|
Il ciclo
turbogetto |
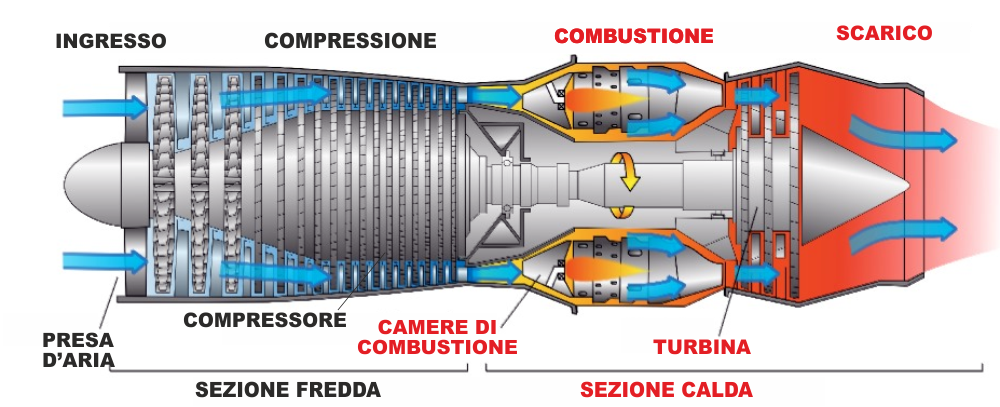
Nel motore turbogetto l'aria viene aspirata e compressa,
poi passa in una camera di combustione dove viene riscaldata
, questo le fa aumentare di volume.
L'aria poi si espande passando su una turbina.
Nelle "turbine a gas" è la turbina che preleva energia dal
fluido e la trasferisce ad un asse, mentre nei motori a
getto è il gas stesso che uscendo ad alta velocità genera la
spinta che muove il velivolo.
La turbina è comunque presente anche nei motori a getto e
serve per dare energia al compressore.
Il ciclo termodinamico delle turbine e gas e dei motori
turbogetto è detto ciclo di Brayton-Joule. |
 |
|
 |
|
I principi della
termodinamica |
Per concludere questa brevissima trattazione della termodinamica
riporto ora l'enunciato dei tre (+ uno) principi fondamentali della
termodinamica.
Sono dei assiomi o postulati, derivati dall'esperienza e che
esprimono le regole fondamentali su cui si basa tutta la teoria
della fluidodinamica.
|
|
Principio ZERO - Lo abbiamo già visto quando abbiamo definito
il concetto di temperatura : Se un corpo A è in equilibrio
termico con un corpo B e il corpo B è in equilibrio termico con un
corpo C allora anche A e C sono in equilibrio termico.Lo abbiamo
già visto ed è il principio che da un senso al concetto di
temperatura. Primo principio - La variazione
dell'energia interna di un sistema termodinamico chiuso è uguale
alla differenza tra il calore fornito al sistema e il lavoro
compiuto dal sistema sull'ambiente. E' il principio che ci da
l'equivalenza tra calore ed energia, è un principio di conservazione
dell'energia - Quando un corpo perde energia meccanica (ad esempio
un'auto che si ferma) questa in realtà si trasforma in energia
termica (i freni si scaldano).
Secondo principio - E' impossibile realizzare una
macchina ciclica che abbia come unico risultato il trasferimento di
calore da un corpo freddo a uno caldo oppure Non è possibile
convertire in lavoro meccanico il calore prelevato da una unica
sorgente.
Questo principio in pratica ci dice che non posso prelevare
energia da un corpo ma solo trasferirla da un corpo che ne ha di più
(più caldo) ad uno che ne ha di meno (più freddo).
Terzo principio - Il terzo principio che in pratica è una
conseguenza diretta del secondo, ci dice che Non è possibile
raggiungere lo ZERO ASSOLUTO. Questo perché per raffreddare un
corpo sino allo zero assoluto dovrei fargli cedere calore ad un
corpo più freddo (secondo il principio precedente).
|
|
|
|
|
|