|
Nella nostra esperienza quotidiana abbiamo spesso avuto a
che fare col concetto di "TEMPERATURA".
Sappiamo che è qualcosa che si misura con un "termometro" e
sappiamo che è legata al concetto di "caldo" e "freddo", che
sono sensazioni che siamo in grado di avvertire direttamente
con il nostro corpo.
Dare una definizione operativa ed efficace di "temperatura"
a questo punto in realtà non è facilissimo.
Più avanti, quando avremo definito cosa intendiamo per
"calore" ci torneremo sopra e sarà più facile.
Per ora direi che la temperatura è una quantità "scalare"
(cioè non è associata ad un vettore) che possiamo misurare
appunto con un "termometro" e che ci fornisce in pratica una
unica indicazione: ci dice se un corpo è più "caldo" di un
altro, e questo serve unicamente a prevedere che se
metteremo i due corpi a contatto il calore passerà dal corpo
più caldo a quello più freddo.
E, intanto, togliamoci dalla testa che la sensazione che noi
proviamo nel toccare un corpo, quella di "caldo" e "freddo"
possa essere efficace per misurare la temperatura.
Noi stiamo comodamente in casa con 22°C in maglietta maniche
corte, ma se ci immergiamo in acqua a 22°C la sentiamo
decisamente fredda.
Questo perché il nostro corpo (che è a 37°C) non è in grado
di valutare una temperatura, ma solo la quantità di calore
che cediamo ad un corpo.
Quando siamo a contatto con l'aria a 22°C noi cediamo
calore, ma se siamo in acqua, sempre a 22°C, che ha una
capacità ed una conducibilità termica (vedremo cos'è più
avanti) più alta che non quella dell'aria (quando avremo le
idee più chiare faremo anche due conti) sentiamo decisamente
freddo.
Il termometro, lo strumento utilizzato per misurare la
temperatura, fu inventato da Gabriel Fahrenheit nel 1709,
inizialmente era realizzato con alcool. Nel 1725 lo stesso
Fahrenheit lo realizzò nella forma poi più utilizzata,
usando come materiale il mercurio.
Nel 1742 Anders Celsius introdusse la scala di misura
"CENTIGRADA" che è poi quella che utilizziamo normalmente
oggi.
Il concetto fondamentale, che passa come "PRINCIPIO ZERO
DELLA TERMODINAMICA", è che se un corpo A è in equilibrio
termico con un corpo B e questo è a sua volta in equilibrio
con un corpo C anche il corpo A e il corpo C sono in
equilibrio termico tra loro.
Cioè, se io ho un corpo A e lo metto in equilibrio con un
termometro (corpo B) che è in grado di misurarne la
temperatura, se poi sposto il corpo B vicino ad un corpo C,
e C e B sono in equilibrio, vuol dire che A e C hanno la
stessa temperatura.
Il termometro è uno strumento che si basa sulla semplice
osservazione che i materiali si dilatano o si restringono in
funzione della temperatura.
Costruito un termometro, che non è altro che un tubicino con
all'interno una sostanza libera di scorrere (alcool o
mercurio), si mette a contatto con un oggetto, si attende
che la sostanza all'interno del tubicino si stabilizzi e
quindi si assegna ARBITRARIAMENTE a quella posizione un
valore.
Per avere una scala univoca si deve ragionare su almeno due
fenomeni "riproducibili".
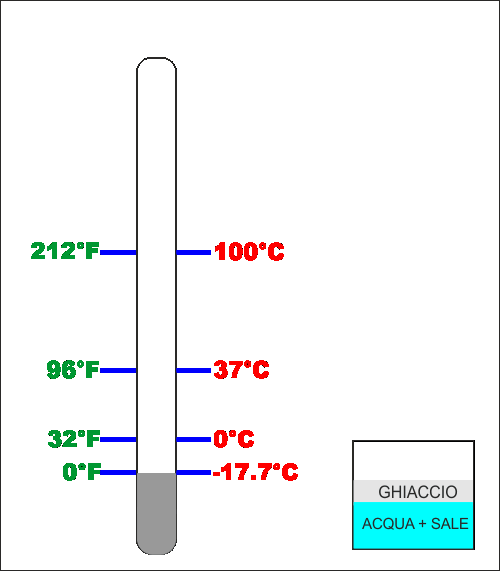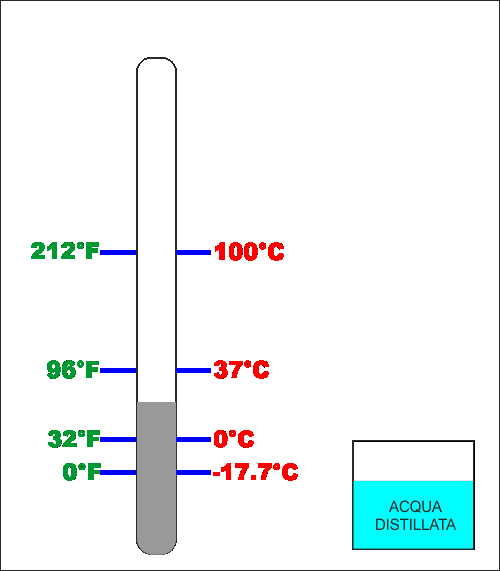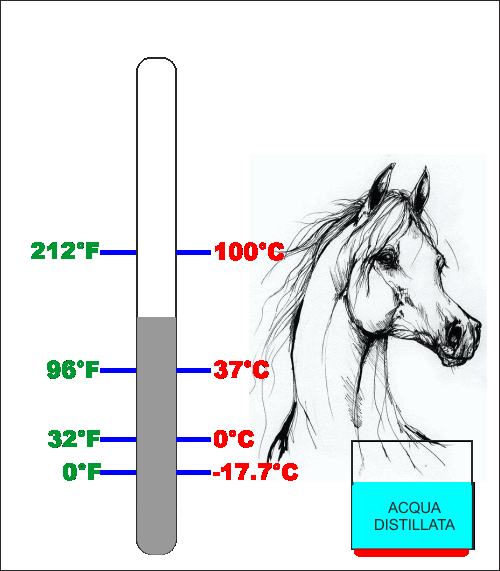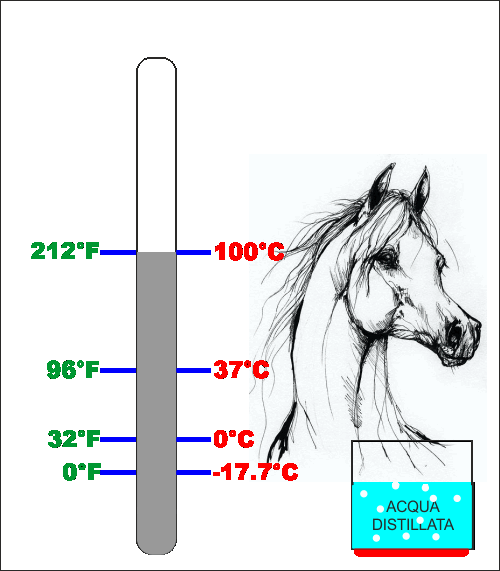
La prima scala adottata da Fahrenheit aveva come "zero" la
temperatura a cui il ghiaccio salato fonde, valore non
precisissimo detto così perché, come fatto in seguito,
dovremmo conoscere esattamente la composizione della miscela
acqua e sale e specifiche condizioni di pressione. Come
secondo riferimento Fahrenheit prese la temperatura del
sangue di un cavallo (circa 37°C) e poi divise questa
distanza in 12 spazi uguali .. ma siccome sembrava poco, la
divise ulteriormente in 8 .. totale 96 gradi tra il ghiaccio
salato che fonde e sangue del cavallo ...
Detta così sembra una cosa bizzarra, ma è perché noi oggi
siamo abituati a vedere le cose con sistemi "decimali" e
quindi ci sembra naturale la scala "Celsius" in gradi
centigradi e in genere ci sembra strano dividere qualcosa in
valori che non siano decimali. |
 |
In realtà prima della Rivoluzione Francese
si tendeva ad utilizzare grandezze che fossero divisibili
più facilmente. Ad esempio il numero 12 è divisibile per 2,
per 3 e per 4 - preferibile al 10 che si può dividere solo
per 2 e per 5, ma se siamo in tre è un casino.
Il numero 60 (e chissà come mai lo utilizziamo ancora oggi
per misurare il tempo e gli angoli...) ad esempio, ha
caratteristiche fantastiche: si divide per 2, per 3, per 4,
per 5, e anche per 6 ... e poi per 10, per 12, per 15 ...
Celsius fece la stesa cosa ma fu un po' più preciso e
utilizzò la temperatura del ghiaccio (di acqua distillata)
che fonde come zero e la stessa acqua distillata che bolle
come 100.
Aggiustamenti successivi fanno in modo che in gradi
Fahrenheit l'acqua ghiaccia (0°C) a 32°F e bolle (100°C)
esattamente a 212°F.
Quindi per ora diciamo che la TEMPERATURA è una proprietà
misurabile come grandezza scalare, che indica lo stato
termico di un sistema, ed in particolare permette di
prevedere il "flusso di calore" che sarà sempre nel senso da
un sistema a temperatura più alta verso un un sistema a
temperatura più bassa. |
 |
 |
 |
 |
 |
 |
 |
|
0 K - NO ENERGIA |
50 K - SOLIDO |
100 K - SOLIDO |
200 K - SOLIDO |
300 K - LIQUIDO |
370 K - LIQUIDO |
400 K - GAS |
Un altro modo per vedere la temperatura è in qualche modo
legarla all'energia di agitazione delle molecole di un
sistema.
E questo già ci aiuta al passaggio successivo, che sarà
quello di legare in qualche modo calore e temperatura
all'energia che conosciamo, che per ora è solo "cinetica"
(legata ad una massa che si muove) o "potenziale" nel senso
di eventuale lavoro fatto da una forza.
Se analizziamo un sistema al microscopio vediamo che le
particelle che lo compongono, maggiore è la temperatura del
sistema e maggiore è il loro movimento. Cioè in qualche modo
la temperatura è legata al movimento e quindi possiamo
pensarla legata all'energia "cinetica" delle particelle del
sistema.
Una prima osservazione sarebbe che, se la temperatura è
legata al movimento delle particelle, se io la abbasso
(raffreddo il sistema, ovvero gli faccio cedere energia) ad
un certo punto queste particelle saranno semplicemente
"ferme".
Se ciò fosse vero esisterebbe un limite minimo di
temperatura: una volta che le particelle sono ferme non è
possibile raffreddare un sistema ulteriormente.
Ed è proprio così.
Questo limite esiste ed è chiamato "ZERO ASSOLUTO" - è la
temperatura minima alla quale si può raffreddare un sistema.
A quella temperatura l'energia di agitazione delle
particelle è zero e di conseguenza il mio sistema non può
cederne. Si è raggiunto un limite.
Tornando al nostro modo di misurare la temperatura, se
utilizzassimo un termometro capace di misurare la
temperatura sino a quel livello troveremmo che lo zero
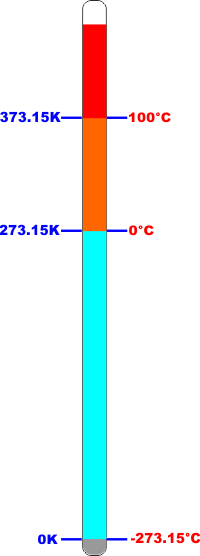
assoluto è a -273,15°C.
E' una temperatura "teorica" irraggiungibile in pratica (per
togliere calore ad un sistema vicino allo zero assoluto
dovrei poterglielo far cedere a qualcosa che deve essere più
freddo di lui).
Nel sistema internazionale di misura l'unità di misura della
temperatura è il Kelvin (che non è "grado Kelvin" ma solo "Kelvin")
ed è quantitativamente uguale al grado centigrado (se vario
la temperatura di un sistema di 1°C la vario anche di 1
Kelvin) ma ha come punto di partenza (lo ZERO) lo zero
assoluto (0 K = -273,15 °C). |
 |
|
L'EQUAZIONE DI STATO DEI GAS (IDEALI) |
Da quello che abbiamo visto prima possiamo immaginare che se
io scaldo un sistema allo stato gassoso, le cui particelle
sono libere di muoversi, più lo scaldo più queste si
muovono.
Quindi, per potersi muovere avranno bisogno di più spazio
...
Immaginate un gruppo di cinquanta persone su un autobus ..
occupano poco spazio ma sono costrette appiccicate le une
alle altre senza potersi muovere..
Se però ad un certo punto decidessero tutte insieme di
sgranchirsi le gambe girando l'autobus lo spazio non
basterebbe, o si allarga l'autobus (aumenta il volume) o
aumenta la pressione (ci sentiamo schiacciare da questi che
vogliono muoversi).
Più o meno è quello che succede nei gas ... se aumento la
temperatura (la gente si muove - le particelle hanno
maggiore energia e quindi si muovono di più) o faccio più
spazio (aumento il volume) o la gente si sentirà schiacciare
(aumenta la pressione).
Se volessimo mettere in "formule" quello che abbiamo detto
verrebbe una cosa del genere : |
|
 |
Cioè se aumento la temperatura faccio aumentare pressione e/o
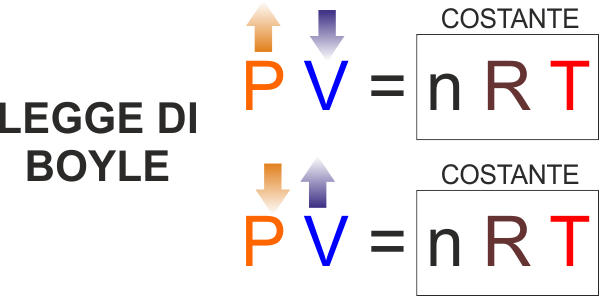
volume .. che è proprio l'equazione dei gas ideali:
PV = nRT (Pressione per Volume è uguale a
numero di moli - vediamo cosa vuol dire ma è come se dicessi massa,
quantità di gas - per Temperatura ... e per una immancabile costante
che serve per "far tornare i conti".
L'equazione di stato dei gas ci basta e ci giustifica anche le leggi
fondamentali della termodinamica:
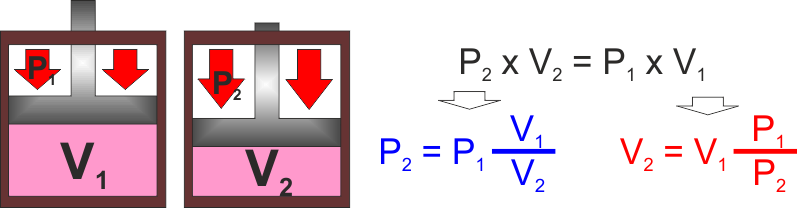
LEGGE DI BOYLE : Trasformazione di un gas a
temperatura costante : Se aumento la pressione mantenendo
costante la temperatura il gas diminuisce il suo volume
(dalla legge che abbiamo appena visto è evidente, mantenendo
costante temperatura e quantità di gas è ovvio che se uno
dei due fattori a primo membro aumenta, dovendo mantenersi
costante il loro prodotto l'altro deve per forza diminuire
in modo inversamente proporzionale.
Ovviamente per lo stesso motivo se aumenta il volume deve
diminuire la pressione.
Una trasformazione a temperatura costante si dice ISOTERMA
(dal greco ISO = STESSA - TERMA = TEMPERATURA) |
 |
|
|
|
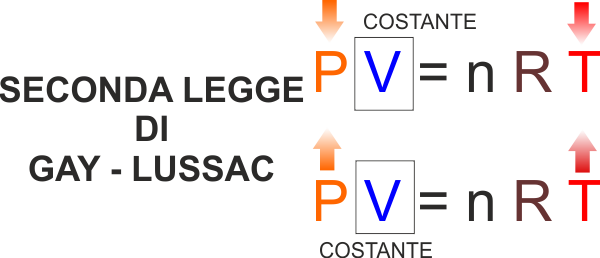
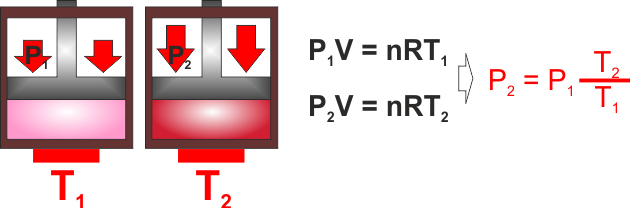
SECONDA LEGGE DI GAY - LUSSAC - Trasformazione di
un gas a volume costante (ISOCORA .. con CORA in greco si
definisce une regione limitata, ISO vuol ancora dire "la
stessa").
Se aumento la temperatura mantenendo costante il volume deve
aumentare la pressione. |
 |
|
 |
|
Manca solo capire cosa è "n", cioè il numero di moli.
In pratica è un valore che indica la quantità di materia con cui
abbiamo a che fare, il concetto non cambierebbe se utilizzassimo una
massa in kg (cambierebbero ovviamente la costante R e le unità di
misura).
Come mole si indica una quantità di materia che contiene un numero
preciso di particelle elementari (atomi o molecole).
In particolare la quantità di materia che contiene tante particelle
quanto è il NUMERO DI AVOGADRO (6,02214076×1023),
che una volta era definito come il numero di atomi contenuti in 12g
dell'isotopo 12 del Carbonio.
Per quanto riguarda però la comprensione di quanto dobbiamo fare la
cosa è abbastanza ininfluente .. il numero di moli è come dire la
"quantità di materia". |
 |
Ora vediamo come possiamo definire il CALORE.
Abbiamo già detto che è una forma di energia ... e ci viene
bene in quanto ogni qual volta abbiamo a che fare con una
sistema "non conservativo" (cioè in pratica sempre se il
sistema è reale) l'energia che ad un certo punto possiamo
misurare (ad esempio l'energia cinetica di un carrello che
si sposta su un binario orizzontale) in teoria dovrebbe
mantenersi, ma in realtà sappiamo che il carrello prima o
poi si ferma.
Quindi la sua energia cinetica dove è finita?
Si è trasformata, appunto, in calore.
Se la cosa non è molto evidente in un carrello che si ferma
lentamente, diventa chiara quando parliamo ad esempio di un
treno o di un'auto che frenano.
L'auto si ferma ma se tocchiamo le pastiglie dei freni le
troviamo calde - l'energia cinetica si è trasformata in
calore per attrito durante la frenata.
Quantificando (cioè esprimendo una unità di misura con la
quale valutare il calore) una prima unità di misura per il
calore fu definita la "CALORIA" che sarebbe la
quantità di calore necessaria a far aumentare la temperatura
di un grammo di acqua distillata da 14.5°C a 15.5°C alla
pressione di 1 atmosfera (1013 hPa).
Successivamente, visto che il calore di fatto è energia, si
è preferito utilizzare la stessa unità di misura
dell'energia e cioè il Joule.
La conversione Caloria/Joule è 1 Caloria = 4,187 Joule.
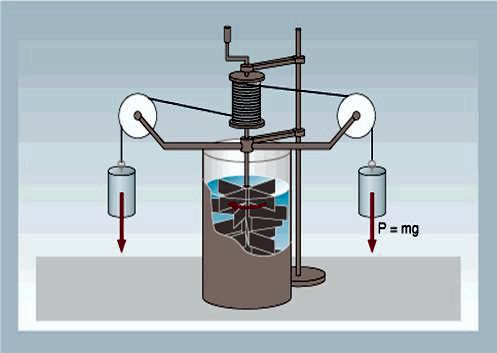
Un metodo per trasformare il lavoro meccanico in calore può
essere quello rappresentato nella figura a lato (mulinello
di Joule).
Si costruisce un sistema composto da un rocchetto a cui sono
collegate delle palette immerse in acqua. Al rocchetto sono
collegati due pesi.
Quando si lasciano i pesi questi scendendo fanno girare le
palette. Il lavoro compiuto dai due pesi è ovviamente il
solito mgh (energia potenziale)
- misurando la variazione di temperatura dell'acqua si
ottiene il rapporto tra lavoro ed aumento di temperatura di
una definita quantità d'acqua, da cui la conversione vista
prima.
Per la definizione efficace di calore, si può indicare come
"energia trasferita tra due sistemi a causa della loro
differenza di temperatura". |
Il trasferimento di calore avviene in natura in tre modi
differenti:
Per contatto e conduzione: Due corpi si toccano e il
calore passa dal corpo più caldo a quello più freddo - diminuisce la
temperatura del più caldo e aumenta quella del più freddo. A seconda
di una caratteristica del materiale che si chiama "conducibilità
termica" uno stesso oggetto scaldato ad una estremità, dopo un po'
di tempo andrà in equilibrio termico con se stesso e quindi anche
l'estremità opposta raggiungerà la medesima temperatura. La
conducibilità termica è una caratteristica, ad esempio, dei
materiali da costruzione. Hanno una piccola conducibilità termica i
materiali che vengono utilizzati come "isolanti" (legno, plastica,
lana, polistirolo, aria) mentre hanno una elevata conducibilità
termica i materiali utilizzati per "disperdere" il calore (in genere
tutti i metalli).
Per convezione: Occorre un fluido (gas o liquido).
Per contatto con un corpo caldo il fluido si scalda e diventa meno
denso (aumenta il suo volume a parità di pressione) e quindi più
leggero. Sale e quindi "trasporta" il calore in alto, scaldando
quindi per contatto un eventuale corpo che vi fosse immerso.
Per irraggiamento : Tutti i corpi emettono radiazioni
elettromagnetiche e tutti i corpi assorbono radiazioni
elettromagnetiche. E' il mezzo con cui il Sole riscalda la nostra
Terra e con cui la nostra Terra cede a sua volta calore allo spazio. |
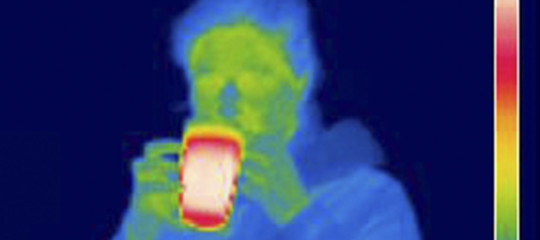 |
I nostri occhi sono capaci di vedere una certa gamma di
radiazioni elettromagnetiche, dal "rosso" al "violetto".
I corpi caldi (ma non troppo) emettono tutti radiazioni più
"lunghe" delle radiazioni rosse (onde radio e "infrarosse")
che i nostri occhi non sono capaci di riconoscere.
Alcuni animali, come i ratti o i felini, sono invece in
grado di utilizzarle, vedendoci quindi anche di notte.
Noi cominciamo a vedere le radiazioni emesse dai corpi solo
oltre una certa temperatura.
E il primo colore che vediamo è appunto il rosso.
Ad esempio un pezzo di ferro riscaldato, diventerà
"luminoso" (cioè riusciremo ad utilizzare le radiazioni
emesse come luce) solo oltre una certa temperatura. |
 |
|
|
I CAMBIAMENTI DI
STATO |
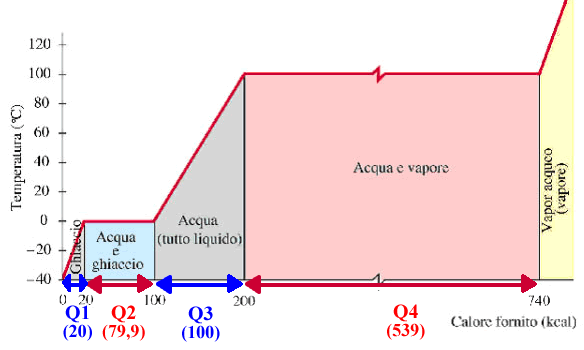 |
Come abbiamo visto la temperatura si può vedere come una
misura dello "stato energetico" delle particelle di un
sistema.
Allo zero assoluto le particelle non hanno energia e quindi
stanno ferme .. sicuramente il nostro sistema avrà l'aspetto
di un solido.
Aumentando la temperatura le particelle cominciano a vibrare
intorno ad una posizione di equilibrio - il nostro sistema è
ancora solido ma, come nell'autobus, se la gente sgomita ha
bisogno di più spazio .. e il nostro solido si dilata
(aumenta di volume).
Ad un certo punto l'energia delle particelle è tale da non
mantenere più una posizione "media", ma cominciano a
spostarsi senza tornare al loro posto (la gente sull'autobus
se ne va in giro).
Prima però di mettersi a ballare occorre che TUTTI si siano
alzati dal loro posto.
Per il nostro sistema abbiamo la trasformazione da solido a
liquido (liquefazione - il suo contrario è solidificazione)
e perché il liquido possa ancora aumentare la sua
temperatura occorre che tutto il sistema abbia cambiato di
stato, cioè che tutto il nostro materiale di si sia
liquefatto.
Durante la trasformazione quindi noi continuiamo a cedere
calore al sistema ma questo non fa aumentare la sua
temperatura.
Il calore "consumato" per trasformare tutto il nostro solido
in liquido è detto "calore latente di trasformazione".
Il calore latente di trasformazione è una quantità specifica
di ogni sostanza.
Anche nella fase successiva di trasformazione da liquido a
vapore è necessario che il nostro sistema riceva calore.
Questo fenomeno è alla base del sistema di termoregolazione
del nostro corpo:
Quando ci surriscaldiamo, ad esempio per l'attività fisica,
il nostro corpo emette sudore (liquido).
Nelle condizioni giuste il sudore va a contatto con l'aria
ed evapora (si trasforma in vapore) ma per farlo ha bisogno
di assorbire calore e lo preleva dal nostro corpo
raffreddandolo.
E' il motivo per cui se l'aria è umida (e quindi incapace di
assorbire ulteriormente umidità) il nostro sudore non
evapora e noi stiamo male (sentiamo caldo perché il nostro
corpo non riesce a disperdere il calore in eccesso).
In linea di principio quando un corpo si scalda le
particelle che lo compongono, sia esso solido, liquido o
gassoso, acquistano energia e quindi hanno bisogno di più
spazio .. il nostro sistema aumenta di volume. |
|
 |
Sappiamo che però non è così per l'acqua,
che quando si solidifica, invece di diminuire, aumenta di
volume.
Questo è dovuto alla particolare struttura "ordinata" dei
cristalli di ghiaccio, che occupa più spazio della struttura
"disordinata" delle molecole d'acqua, anche se queste sono
in movimento. |
 |
 |
|
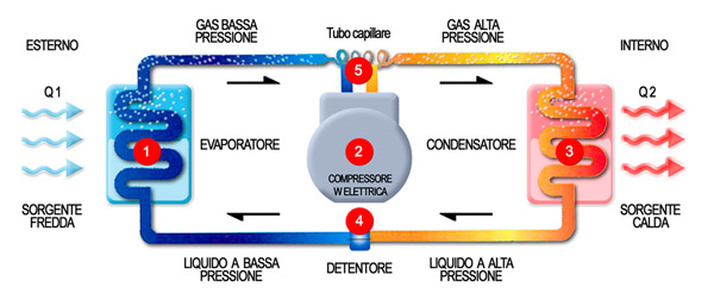
Come funziona un frigorifero?
Abbiamo detto che un corpo non può cedere calore ad un altro
corpo più caldo. Ma allora come facciamo a raffreddare anche
sotto zero i nostri freezer?
Prendiamo un gas a temperatura "ambiente", grazie ad un
compressore azionato elettricamente, lo comprimiamo.
Aumentando la pressione aumenta la temperatura. Mandiamo il
gas compresso in uno "scambiatore di calore". In questo
momento il gas (compresso) è più caldo di quanto era prima e
quindi può cedere calore all'ambiente.
Quindi il gas ad alta pressione si raffredda (in teoria
potrebbe raffreddarsi sino a tornare alla temperatura che
aveva prima di comprimerlo).
Raffreddandosi, ad alta pressione, raggiunge la temperatura
di condensazione e diventa liquido.
A questo punto abbiamo un liquido ad alta pressione che
però, se le cose hanno funzionato bene è a temperatura
ambiente.
Sino ad ora abbiamo "riscaldato" l'ambiente (è il motivo per
cui i condensatori, cioè gli scambiatori di calore dei
condizionatori, devono essere messi all'aperto, se no quello
che raffreddiamo ce lo saremmo già "mangiato" con questa
stufetta - è il principio dei moderni riscaldatori a "pompa
di calore"), ma abbiamo un fluido compresso a temperatura
ambiente.
Facciamo passare il fluido compresso in un "evaporatore" che
semplicemente è un dispositivo che permette al fluidi di
espandersi, tornando allo stato gassoso.
Durante l'espansione non solo il mio fluido diminuisce di
pressione e quindi anche di temperatura, ma siccome cambia
pure di stato, passando da liquido a gas, necessita di quel
"calore latente di trasformazione" di cui avevamo parlato
prima, e lo va a prendere all'interno dell'ambiente che
vogliamo raffreddare, che quindi cede calore e scende di
temperatura. |
 |
|
|